Unsur-unsur yang ada di alam pada umumnya tidak terdapat dalam bentuk bebas. Contoh logam Besi Fe terdapat dalam mineral hematite Fe2O3 dan magnetit Fe3O4. Contoh lain adalah logam Tembaga Cu terdapat dalam mineral kalkopirit CuFeS2, logam Cobalt Co dalam mineral cobaltit CoAsS. Tidak hanya logam, non logam juga terdapat dalam bentuk mineralnya seperti belerang (S) dalam mineral gypsum CaSO4.2H2O), klorin dalam mineral carnalite KMgCl3.6H2O) dsb.
Namun terdapat juga satu kelompok atau golongan unsur yang keberadaannya bebas atau stabil di alam. Stabil artinya tidak terdapat dalam bentuk mineral atau bersenyawa atau bereaksi dengan unsur/atom lain melainkan berdiri sendiri. Golongan unsur yang dimaksud adalah golongan VIIIA atau golongan unsur gas mulia yaitu Helium, Neon, Argon, Kripton, Xenon, dan Radon.
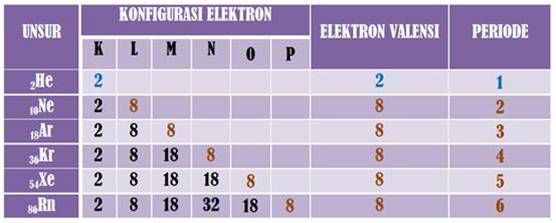
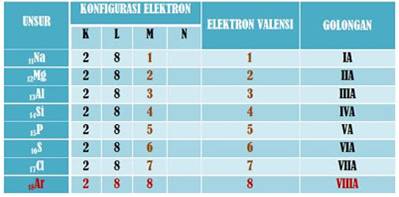
Unsur golongan gas mulia stabil dikarenakan memiliki jumlah elektron 2 (He) dan 8 pada kulit terluarnya. Berikut ini perbandingan elektron valensi unsur lain pada periode ketiga:
Untuk menggambarkan bagaimana atom-atom berikatan, digunakan struktur Lewis. G. N. Lewis menggambarkan susunan elektron dari suatu atom tanpa melibatkan elektron dalam, melainkan hanya menggunakan elektron valensi.
Struktur Lewis dari suatu molekul adalah cara menggambarkan bagaimana atom-atom berikatan membentuk molekul dengan menggunakan penanda seperti titik untuk mewakili elektron yang terlibat dalam pembentukan molekul.

Telah dijelaskan bahwa unsur golongan gas mulia stabil karena memiliki 2 atau 8 elektron pada kulit terluarnya. Unsur selain gas mulia dapat mencapai kestabilan dengan cara berikatan dengan unsur lain membentuk senyawa agar susunan elektron terluarnya menyerupai gas mulia
Ikatan Ion
Ikatan ion adalah ikatan yang terjadi akibat gaya tarik-menarik antara ion positif dan ion negatif. Ion positif melepaskan elektron dan ion negatif menerima elektron.
Contoh:
11Na mempunyai konfigurasi elektron: 2 8 1, sedangkan elektron valensinya adalah 1.
Jadi, Na melepaskan 1 elektron valensi.
17Cl mempunyai konfigurasi elektron adalah: 2 8 7, sedangkan elektron valensinya adalah 7.
Jadi, Cl menerima 1 elektron valensi.
11Na : 2, 8, 1 ® Na+ : 2, 8, – + e–
17Cl : 2, 8, 7 + e– ® Cl– : 2, 8, 8
Kemudian antara Na+ dengan Cl– terjadi tarik menarik dan terbentuklah ikatan ion dan molekul NaCl
Ikatan Kovalen
Ikatan kovalen adalah ikatan antar atom yang terjadi karena pemakaian bersama pasangan elektron. Ikatan kovalen dapat terbentuk antara: • atom non logam dengan atom non logam yang lain; atau • atom non logam yang sejenis.
Untuk menggambarkan ikatan kovalen, perlu diperhatikan poin-poin berikut:
- Kebutuhan unsur nonlogam terhadap elektron:
- Hidrogen (H) butuh 1 e– untuk mencapai duplet
- Golongan VIIA butuh 1 e– untuk mencapai oktet
- Golongan VIA butuh 2 e– untuk mencapai oktet
- Golongan VA butuh 3 e– untuk mencapai oktet
- Golongan IVA butuh 4 e– untuk mencapai oktet
- Unsur-unsur yang memiliki keelektronegatifan rendah (lebih butuh banyak e–) akan menjadi atom pusat.
- Bila 2 unsur yang berada dalam golongan yang sama saling berikatan, maka unsur yang menjadi atom pusat adalah unsur yang memiliki jari-jari lebih besar (berada di bawah).
Untuk menggambarkan ikatan kovalen, biasanya digunakan struktur Lewis. Tiga hal yang harus diperhatikan dalam membuat rumus Lewis molekul adalah:
- Pasangan elektron yang dipakai bersama-sama diletakkan di antara lambang ke dua atom yang berikatan.
- Sesudah berikatan setiap atom harus dikelilingi 8 elektron kecuali H (hanya 2 elektron).
- Pasangan elektron yang berikatan diberi tanda garis (―, =, ≡)
Untuk lebih memahami mengenai materi ikatan kimia, coba kerjakan soal pada link berikut

